Физические представления о горении топлива
Физические представления о горении топлива - это быстро протекающий физико - химический процесс взаимодействия горючей его части с окислителем, сопровождающийся выделением теплоты и света.
В результате полного горения получаются газообразные негорючие продукты окисления (СО2, Н2О и др.) и твердый негорючий остаток (зола или шлак). При неполном горении газообразные продукты и твердый остаток содержат некоторое количество горючих веществ (СО, Н2, С и др.), и при этом выделяется меньше теплоты, чем при полном горении. Процессы горения можно разделить на две группы:
- горение газообразных горючих - гомогенное горение (характеризуется системой "газ + газ");
- горение твердых и жидких горючих - гетерогенное горение (характеризуется системой "твердое тело + газ" или "жидкость + газ").
Горение - это прежде всего химический процесс, так как в результате его протекания происходят качественные изменения состава реагирующих масс. Изучение химических процессов при горении относится в основном к области химической термодинамики. При этом исследуют статику и кинетику процесса. В основе изучения химизма процесса горения лежат фундаментальные законы: сохранения массы (Ломоносов - Лавуазье), простых кратных отношений (Дальтон) и учение о химическом равновесии (закон действующих масс). Эти законы дают ответ на вопросы о соотношении вступающих в реакцию соединений и составе получающихся продуктов реакции, о направлении и глубине протекания реакций и т.д. Горение как химический процесс, происходящий при весьма высоких температурах, может протекать с высокими скоростями. Однако, обладая высокими потенциальными возможностями по быстроте протекания, процесс горения в действительности имеет ограниченную скорость. Это происходит потому, что химические реакции веществ сопровождаются различными физическими явлениями: переносом теплоты, диффузионным переносом реагирующих масс и др. Эти физические процессы развиваются по присущим им закономерностям, имеют свои скорости, которые в ряде случаев являются определяющими. Иными словами, это обстоятельство можно пояснить следующим образом. Если скорость химической реакции велика по сравнению со скоростью переноса теплоты или скоростью диффузии масс, то результирующая скорости процесса будет определяться именно скоростью переноса теплоты или скоростью диффузии окислителя как наиболее медленных процессов. Таким образом, химический процесс, составляющий основу горения, оказывается подчиненным закономерностям протекания физических процессов и ими регулируется.
В общем случае время горения топлива складывается из времени протекания физических τфиз и химических τхим процессов, т. е.
τгор = τфиз + τхим (18.19)
Время протекания физических процессов Тфиз в свою очередь состоит из времени, необходимого для смешивания топлива с окислителем τсм, и времени, в течение которого топливо - воздушная смесь - подогревается до температуры воспламенения тн, т. е.
τфиз = τсм+ тн (18.20)
Время горения Тгор будет определяться в основном скоростью наиболее медленного процесса.
Физические представления о горении топлива - горение газообразного топлива. Процесс горения газообразного топлива гомогенный, т. е. и топливо, и окислитель находятся в одном агрегатном состоянии и граница раздела фаз отсутствует. Для того чтобы началось горение, газ должен соприкасаться с окислителем. При наличии окислителя для начала горения необходимо создать определенные условия. Окисление горючих составляющих возможно и при относительно низких температурах. В этих условиях скорости химических реакций имеют незначительную величину. С повышением температуры скорость реакций возрастает. При достижении некоторой температуры газовоздушная смесь воспламеняется, скорости реакций резко возрастает и количество теплоты становится достаточным для самопроизвольного поддержания горения. Минимальная температура, при которой происходит воспламенение смеси, называется температурой воспламенения. Значение этой температуры для различных газов неодинаково и зависит от теплофизических свойств горючих газов содержания горючего в смеси, условий зажигания, условий отвода теплоты в каждом конкретном устройстве и т. д. Например, температура воспламенения водорода находится в пределах 820 - 870 К, а окиси углерода и метана - соответственно 870 - 930 и 1020 - 1070 К.
Горючий газ в смеси с окислителем сгорает в факеле. Факел - некоторый определенный объем движущихся газов, в котором протекают процессы горения. В соответствии с общими положениями теории горения различают два принципиально различных метода сжигания газа в факеле - кинетический и диффузионный. Для кинетического сжигания характерно предварительное (до начала горения) смешивание газа с окислителем. Газ и окислитель подаются сначала в смешивающее устройство горелки. Горение смеси осуществляется вне пределов смесителя. В этом случае скорость процесса будет лимитироваться скоростью химических реакций горения и τгор τхим.
Диффузионное горение происходит в процессе смешивания горючего газа с воздухом. Газ поступает в рабочий объем отдельно от воздуха. Скорость процесса в данном случае будет ограничена скоростью смешивания газа с воздухом и τгор = τфиз.
Разновидностью диффузионного горения является смешанное (диффузионно - кинетическое) горение. Газ предварительно смешивается с некоторым (недостаточным для полного горения) количеством воздуха. Этот воздух называется первичным. Образовавшаяся смесь подается в рабочий объем. Туда же отдельно от нее поступает остальная часть воздуха (вторичный воздух).
В топках котельных агрегатов чаще используются кинетический и смешанный принципы сжигания топлива. Диффузионный способ чаще всего используется в технологических промышленных печах.
Структура и длина факела при прочих равных условиях зависят от режима потока. Различают ламинарный и турбулентный газовые факелы. Ламинарный факел образуется при небольших скоростях истечения смеси (Re < 2300). Ламинарный режим сохраняется только на некотором расстоянии от среза горелки. Затем вследствие процессов массообмена с окружающей средой происходит турбулизация факела. При Re > 3000 факел становится турбулентным уже около среза горелочного устройства.
Горение газа происходит в узкой зоне, называемой фронтом горения. Газ, предварительно перемешанный с окислителем, сгорает во фронте горения, который называется кинетическим. Этот фронт представляет собой поверхность раздела между свежей газовоздушной смесью и продуктами сгорания. Площадь поверхности кинетического фронта горения определяется скоростью химических реакций.
В случае диффузионного сжигания газа образуется диффузионный фронт горения, который является поверхностью раздела между продуктами сгорания и смесью газа с продуктами сгорания, диффундирующими навстречу потоку газа. Площадь поверхности этого фронта определяется скоростью смешивания газа с окислителем.
Диффузионно - кинетическое сжигание газа характеризуется наличием двух фронтов. При кинетическом сжигании расходуется окислитель, подаваемый в смеси с газом; при диффузионном догорает та часть газа, которая не сгорела при кинетическом сжигании из - за недостатка окислителя.
На рис. 18.3 показаны структура горящих факелов при различных способах сжигания и схема фронта горения.
Набегающая свежая газовоздушная смесь нагревается за счет передачи теплоты путем теплопроводности и излучения от фронта горения. Подогретая до температуры воспламенения смесь сгорает во фронте горения, а продукты сгорания покидают эту зону и частично диффундируют в набегающую смесь. Положение фронта горения над срезом горелки зависит от физической природы горючего газа, концентрации его в смеси, скорости потока и других факторов. Фронт горения может перемещаться в направлении, нормальном к своей поверхности, до установления равенства между количествами сгоревшей, и поступившей смеси, отнесенными к единице поверхности фронта. При этом выполняется и тепловое равновесие: поток теплоты от фронта горения уравновешивается встречным потоком переносимого холодного исходного газа.
Важнейшей характеристикой горения газообразного топлива является скорость нормального распространения пламени ин - скорость, с которой перемещается фронт горения по нормали к своей поверхности в направлении набегающей газовоздушной смеси. При равенстве ин и проекции вектора скорости потока на нормаль к поверхности фронта wн этот фронт будет неподвижным по отношению к срезу горелки. Основными факторами, от которых зависит скорость нормального распространения пламени, являются реакционная способность газа, его концентрация в смеси, температура предварительного подогрева смеси.
На рис. 18.4 приведены зависимости ин от концентрации газа в смеси и температуры ее подогрева для некоторых газов. Реакционная способность газа определяется величиной энергии активации.
Очевидно, что газы, обладающие небольшой энергией активации, реагируют с окислителем с большей скоростью, и для этих газов характерны высокие скорости распространения пламени (водород, ацетилен). Количество теплоты, выделяемой при горении, и температура во фронте горения зависят от концентрации газа и смеси. Начальный подогрев смеси увеличивает температуру во фронте. Следовательно, скорость распространения пламени зависит от концентрации газа и температуры подогрева исходной газовоздушной смеси. Величина ин является важной характеристикой при выборе и расчете горелочных устройств. Если скорость истечения смеси будет значительно превосходить скорость распространения пламени, то может произойти отрыв факела. Если скорости истечения значительно меньше скоростей распространения пламени, то наблюдается втягивание (проскок) пламени в горелку.
Физические представления о горении топлива (газовоздушных смесей) - наличие концентрационных пределов. Различают нижний (НПВ) и верхний (ВПВ) концентрационные пределы воспламенения. Горение газа прекращается, если его концентрация в смеси будет меньше, чем концентрация на НПВ, или больше, чем на ВПВ. Это связано с тем, что при малых концентрациях газа теплоты становится явно недостаточно для поддержания реакции. При больших концентрациях газа ощущается нехватка окислителя, что приводит также к уменьшению количества теплоты и спаду температуры во фронте горения ниже температуры воспламенения.
Физические представления о горении топлива - горение твердого топлива. Процесс горения твердого топлива состоит из ряда последовательных стадий (иногда накладывающихся частично одна на другую): 1) подсушка топлива и нагревание до температуры начала выхода летучих веществ; 2) воспламенение летучих веществ и их выгорание; 3) нагревание кокса до воспламенения; 4) выгорание горючих веществ из кокса.
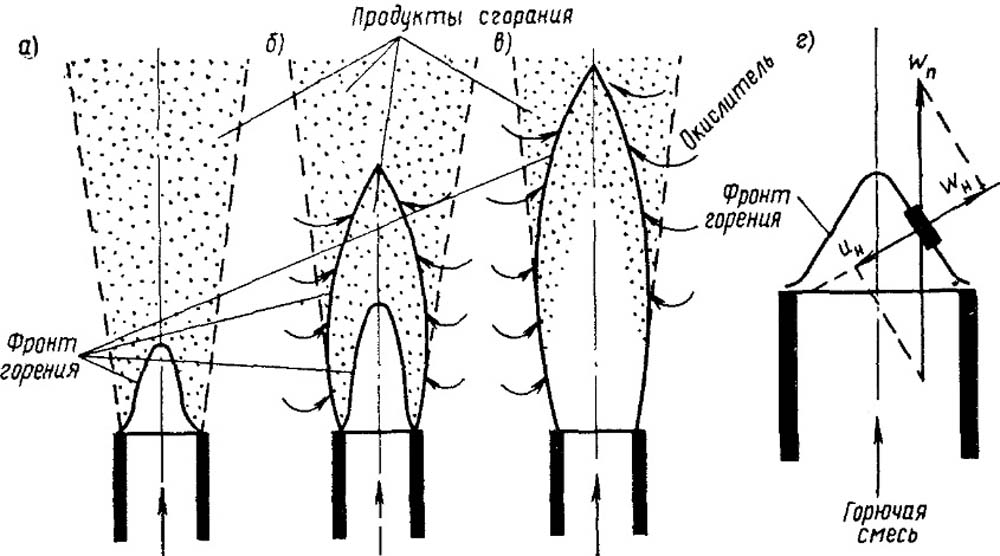
Рис 18.3 Структура фронта горения факелов кинетического (а), смешанного (б) диффузионного (в),а также схема фронта гореня.
wn - скорость потока; ин - скорость нормального распространения пламени; wн - проекция wп на нормаль n.
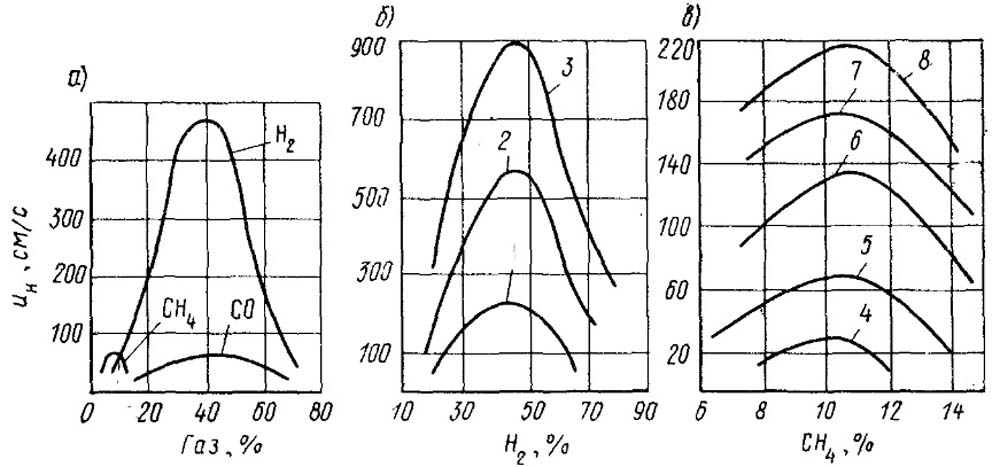
Рис. 18.4. Зависимость скорости нормального распространения пламени ин от концентрации газа в смеси (а), а также от температуры подогрева смеси для водорода (б) и метана (в).
1, 2, 3, 4, 5, 6, 7 и 8 - при температуре, соответственно равной 293, 463, 583, 293, 473, 623, 743 и 793 К.
Для большинства ископаемых топлив горение углерода коксового остатка - наиболее длительный процесс. Однако он сопровождается горением летучих веществ, которые выделяются в результате термического разложения органической массы топлива при его нагревании. Выход летучих веществ у различных топлив начинается при различных температурах: например, у торфа при 550 - 660 К, у бурых углей при 690 - 710 К, у тощих углей и антрацита при 1050 - 1070 К.
Следует отметить, что на процесс горения летучие вещества оказывают двоякое влияние. С одной стороны, от горящего факела летучих быстрее прогревается кокс, а с другой - летучие, образуя вокруг топливной частицы горящую оболочку, перехватывают весь кислород, и вследствие этого горение кокса сильно затормаживается или вообще не наблюдается до их выгорания. По мере уменьшения выхода летучих количество кислорода, достигающего поверхности топливной частицы, увеличивается и кокс начинает выгорать быстрее.
При горении топлив с низким выходом летучих (тощие угли, полуантрациты, антрациты) выход летучих заканчивается очень быстро и время горения топливной частицы определяется в основном временем горения кокса. Для топлив, богатых летучими (торф, сланцы), время выхода и горения летучих становится соизмеримым со временем горения коксового остатка.
Скорость горения топливной частицы определяется количеством веществ, сгорающих на единице площади ее поверхности в единицу времени, обозначается Ks и имеет единицу измерения (м2 /с). Эта скорость возрастает с увеличением реакционной способности твердого топлива, температуры, концентрации окислителя и скорости обдувания частицы потоком воздуха. Уменьшение размера частицы также приводит к увеличению скорости горения.
Скорость горения частицы зависит от интенсивности химической реакции горючего с окислителем и от скорости подвода (диффузии) окислителя к топливу. Результирующая скорость горения будет определяться скоростью наиболее медленного процесса. При этом различают три области горения: кинетическую, промежуточную, диффузионную. В кинетической области скорость горения зависит только от температуры процесса, т. е. определяется скоростью химической реакции. С ростом температуры скорость реакции возрастает. Скорость реакции будет увеличиваться до тех пор, пока она не станет равной скорости подвода окислителя.
В промежуточной области скорость химической реакции и скорость диффузии имеют соизмеримые значения. Подведенный к топливу окислитель целиком расходуется на горение. В диффузионной области скорость диффузии становится лимитирующей, так как скорость химической реакции при достаточном количестве окислителя достигает несоизмеримо более высоких значений. Подвод окислителя к топливу (диффузия) - медленный процесс. Для увеличения скорости диффузии и снижения диффузионного сопротивления подводу окислителя необходимо увеличить скорость обдувания частицы потоком окислителя. Такой способ интенсификации процесса часто используется в теплотехнической практике.
На рис. 18.5 показаны области протекания процесса горения частицы твердого топлива. При горении частицы топлива с высоким содержанием золы образуется покровный зольный слой, толщина которого со временем возрастает.
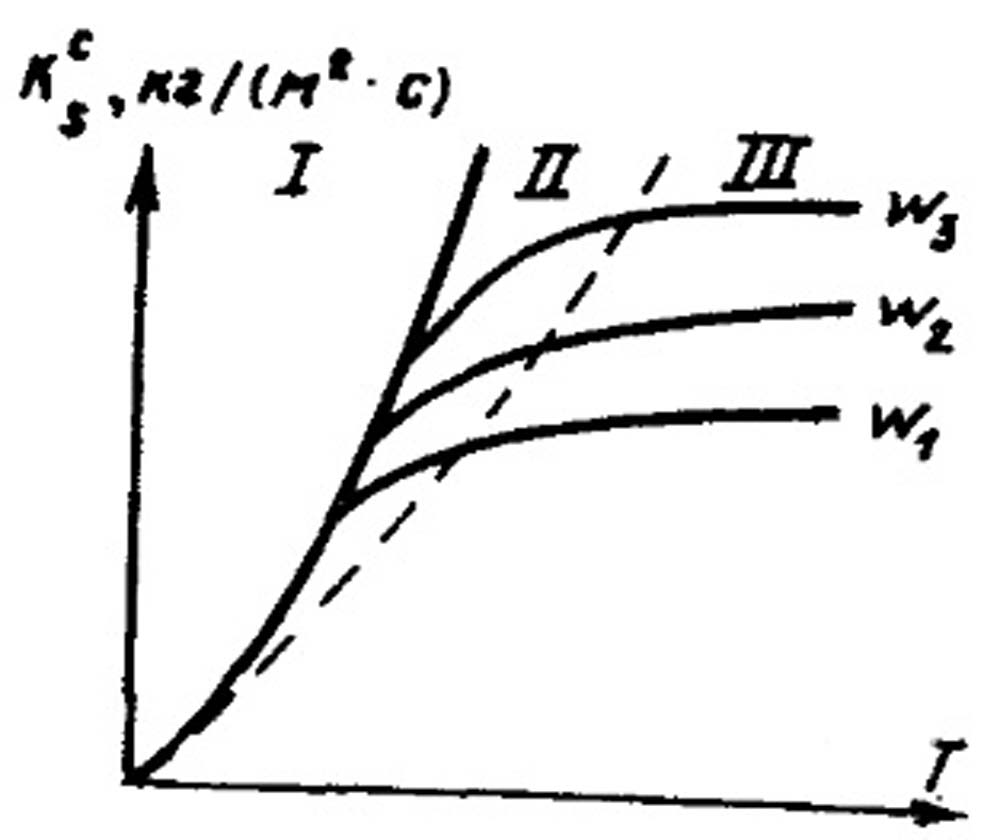
Рис. 18.5. Зависимость скорости горения антрацита К s/с от температуры Т и скорости обдувания w.
Области горения: I - кинетическая; II - диффузионно - кинетическая; III - диффузионная; w3 >w2 > w1.
Покровный слой затрудняет подвод окислителя внутрь частицы. На практике при сжигании высокозольного угля в слое для интенсификации процесса применяют механическое разрушение топливных кусков (шуровка, ворошение и т. д., см. § 19.1).
Физические предстваления о горении топлива - горение жидкого топлива. Основным жидким топливом, используемым в теплоэнергетике и промышленной теплотехнике, является мазут. В настоящее время в установках небольшой мощности
используется также печное топливо, представляющее собой смесь технического керосина со смолами.
Наибольшее практическое применение имеет метод сжигания жидкого топлива в распыленном состоянии. Распыление топлива позволяет значительно ускорить его сгорание и получить высокие тепловые напряжения объемов топочных камер вследствие увеличения площади поверхности контакта топлива с окислителем.
Температура кипения жидких топлив всегда ниже температуры их самовоспламенения, т. е. той минимальной температуры среды, начиная с которой топливо воспламеняется и в дальнейшем горит без постороннего теплового источника. Эта температура выше, чем температура воспламенения, при которой топливо горит только в присутствии постороннего источника зажигания (искры, раскаленной спирали и т. п.). Вследствие этого при наличии окислителя горение жидких топлив возможно только в парообразном состоянии. Это обстоятельство является важнейшим для понимания механизма процесса горения жидкого топлива. Процесс этот можно разделить на следующие стадии: 1) нагревание и испарение топлива; 2) образование горючей смеси (перемешивание паров топлива с окислителем); 3) воспламенение горючей смеси; 4) собственно горение смеси.
Капля жидкого топлива, попавшая в нагретый объем, температура которого выше температуры самовоспламенения, начинает частично испаряться. Пары топлива смешиваются с воздухом, и образуется паровоздушная смесь. Воспламенение происходит в тот момент, когда концентрация паров в смеси достигнет величины, превышающей ее значение на нижнем концентрационном пределе воспламенения. Горение затем поддерживается самопроизвольно за счет теплоты, получаемой каплей от сжигания горючей смеси. Начиная с момента воспламенения скорость процесса испарения возрастает, так как температура горения горючей паровоздушной смеси значительно превышает начальную температуру объема, куда вводится распыленное топливо.
Таким образом, горение жидкого топлива характеризуется двумя взаимосвязанными процессами: испарением топлива вследствие выделения теплоты от горящей паровоздушной смеси и собственно горением этой смеси около поверхности капли. Гомогенное горение паровоздушной смеси - это химический процесс, а процесс испарения является по своей природе физическим. Результирующая скорость и время горения жидкого топлива будут определяться интенсивностью протекания физического или химического процесса.
Если скорость сгорания образующихся паров значительно превышает скорость испарения топлива, то за скорость горения принимают скорость испарения и тогда τгор = τисп = τфиз .
В противном случае, когда скорость химического взаимодействия паров с окислителем значительно ниже скорости испарения топлива, интенсивность процесса сжигания будет целиком зависеть от скорости протекания химических реакций горения паровоздушной смеси и τгор = τхим.
Испарение капли - наиболее длительная стадия горения жидкого топлива. Поэтому для успешного и экономичного сжигания жидкого топлива необходимо увеличивать дисперсность распыления.