Расход воздуха на горение и количество продуктов сгорания топлива
Горючие вещества топлива взаимодействуют с кислородом воздуха в определенном количественном соотношении. Расход воздуха на горение и количество продуктов сгорания топлива рассчитывают по стехиометрическим уравнениям горения, которые записывают для 1 км для каждой горючей составляющей.
Теоретический и действительный расход воздуха на горение и количество продуктов сгорания топлива. Стехиометрические уравнения горения горючих составляющих твердого и жидкого топлива имеют вид:
углерода С + О2 = СО2:
12 кг С + 32 кг О2 = 44 КГ СО2;
1 кг С + (32 : 12) кг O2 = (44 : 12) кг СO2 (18.21)
cеры S + O2 = SO2:
32 кг S + 32 кг O2 = 64 кг SO2;
1 кг S + 1 кг O2 = 2 кг SO2; (18.22)
водорода 2Н2 + O2 = 2Н2О:
4 кг Н2 + 32 кг О2 = 36 кг Н2О;
1 кг Н2 + 8 кг О2 = 9 кг Н2 (18.23)
В топливе находится Ср/100 кг углерода, Sр/л 100 кг летучей серы, Нр/100 кг водорода и Ор/100 кг кислорода. Следовательно, суммарный расход кислорода, необходимого для горения 1 кг топлива, по стехиометрическим уравнениям будет равен:
![]()
Массовая доля кислорода в воздухе равна 0,232. Тогда массовое количество воздуха определяют из формулы:
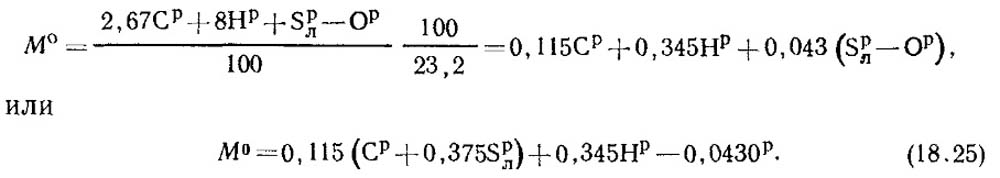
При нормальных условиях плотность воздуха р0 = 1,293 кг/м3.
Расход воздуха на горение и количество продуктов сгорания топлива легко рассчитать как:
V0 = M0/1,293 м3 воздуха/кг топлива.(18.26)
Таким образом,
V0 = 0,0889 (Ср + 0,375Sp/л) + 0,265Нр - 0,033Ор(18.27)
Для газообразного топлива расход V0 определяют, исходя из объемных долей горючих компонентов, входящих в состав газа, с использованием стехиометрических реакций:
Н2 + 0,5О2 = Н2О;
СО + 0,5О2 = СО2;
СН4 + 2О2= СО2 + 2Н2О;
H2S+1,5О2 = SО2+H2О. (18.28)
Теоретическое количество воздуха, м3/м3, необходимого для сжигания газа, определяют по формуле:
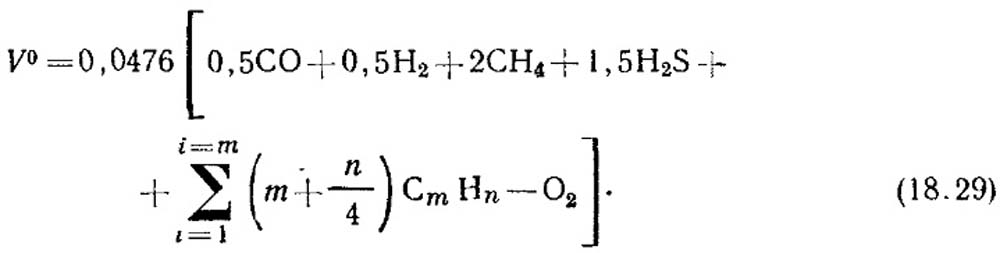
Объемную концентрацию компонентов, %, подставляют в уравнение (18.29). Если данных о концентрации непредельных углеводородов нет, считают, что они состоят из С2Н4.
Количество воздуха Vn, рассчитываемого по стехиометрическим уравнениям (18.27) и (18.29), называется теоретически необходимым, т. е. величина V0 представляет собой минимальное количество воздуха, необходимое для обеспечения полного сгорания 1 кг (1 м3) топлива при условии, что весь кислород в нем и кислород, содержащийся в топливе, будут использованы при горении.
Из-за определенных трудностей в организации процесса полного перемешивания топлива с воздухом в рабочем объеме топок могут появиться области, где будет ощущаться местный недостаток или избыток окислителя. В результате этого качествои и расход воздуха на горение и количество продуктов сгорания топлива ухудшается. Поэтому в реальных условиях воздух для горения топлива подается в большем количестве по сравнению с его теоретическим количеством V0. Отношение действительного количества воздуха, подаваемого в топку, к теоретически необходимому называется коэффициентом избытка воздуха:
α = Vд/V0.(18.30)
При проектировании и тепловом расчете топок или других камер сгорания значение а выбирают в зависимости от вида сжигаемого топлива, способа сжигания и конструктивных особенностей топочных камер. Значение а колеблется в пределах 1,02 - 1,5.
Состав и количество продуктов полного сгорания топлива. Продукты полного сгорания топлива при α = 1 содержат: сухие (неконденсирующиеся в котельном агрегате) трехатомные газы СO2 и SO2;
Н2O - водяной пар, полученный при горении водорода; N2 - азот топлива и азот, находящийся в теоретически необходимом количестве воздуха.
Кроме того, в состав продуктов сгорания входят водяной пар, получающийся при испарении влаги топлива, пар, вносимый в топку с влажным воздухом, и пар, используемый иногда при сжигании мазута для распыления. При температуре продуктов сгорания ниже температуры точки росы водяной пар конденсируется. При полном горении с α = 1 в продуктах сгорания будут содержаться только СO2, SO2, Н2O и N2; если α > 1, то в них будет присутствовать и избыточный воздух, т. е. дополнительное количество кислорода и азота.
Процентное содержание соответствующих газов по объему обозначим через СO2, N2,SO2 и т. д. , а через Vсо2, Vso2, Vn2, и т.д. - их объемы, получающиеся при сжигании 1 кг (1 м3) топлива, приведенные к нормальным условиям (индекс 0 показывает, что расчеты производятся при α = 1). Тогда получим:
СО2 + SO2 + N0/2 + Н2O2 = 100 %
или
V0/r = Vco2 + VS2O + V0/N2 + V0H2O(18.31)
Где Vo/r - суммарный объем продуктов сгорания, приведенный к нормальным условиям, м3/кг.
Для упрощения расчетов объемы сухих трехатомных газов подсчитывают совместно и сумму их условно обозначают символом RO2, т. е.
Vro2 = Vco2 + Vso2(18.32)
Сумма первых трех компонентов в равенстве (18.31) представляет собой объем сухих газов Vс.p и, следовательно,
Vor = Voc.г + V0H2O (18.33)
где V0c.r = Vro2 + V0N2
Величины V0N2, V0Н2О, V0c.r, V0 и Vro2 - это теоретические объемы газов при сжигании 1 кг твердого или жидкого топлива.В соответствии с уравнениями (18.21) и (18.22) масса трехатомных газов равна:
![]()
Плотности двуокиси углерода и сернистого газа, приведенные к нормальным условиям, соответственно равны рсо2 = 1,964 кг/м3 и Pso2 = 2,86 кг/м3. Тогда объем трехатомных газов VRO2 можно определить по формуле:

Теоретический объем водяных паров, образующихся при горении водорода VrH2O, определяем в соответствии с уравнением (18.23). К этому объему необходимо добавить объем пара, образующегося при испарении влаги топлива VrH2O. объем форсуночного пара VфH2O и объем водяного пара, содержащегося в воздухе Vвз Н2О тогда:
где 0,805 - плотность водяного пара при нормальных физических условиях, кг/м3; Wф - расход форсуночного пара (принимается Wф = 0,3 ÷ 0,35 кг/кг),
d - влагосодержание воздуха (обычно принимается d = 13 г/м3).
Полный теоретический объем водяные паров определяют по формуле:
V0 H2O = 0,111Нр + 0,0124 Wр+ 1,24 Wф + 0,0161 V0 (18.41)
Теоретический объем азота (1 м3 на 1 кг топлива) при α = 1 состоит из азота воздуха и азота топлива, т. е.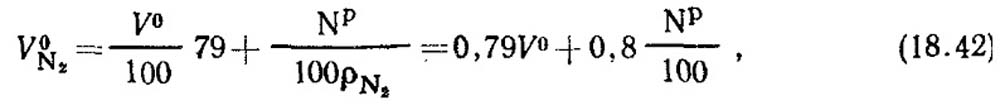
где pN2 = 1,25 - плотность азота, кг/м3.
При коэффициенте избытка воздуха α > 1 в состав продуктов сгорания дополнительно будут входить избыточный воздух и водяные пары, вносимые с этим воздухом. Объемы продуктов сгорания при
α = 1 называются действительными объемами.
Действительные объемы составят:
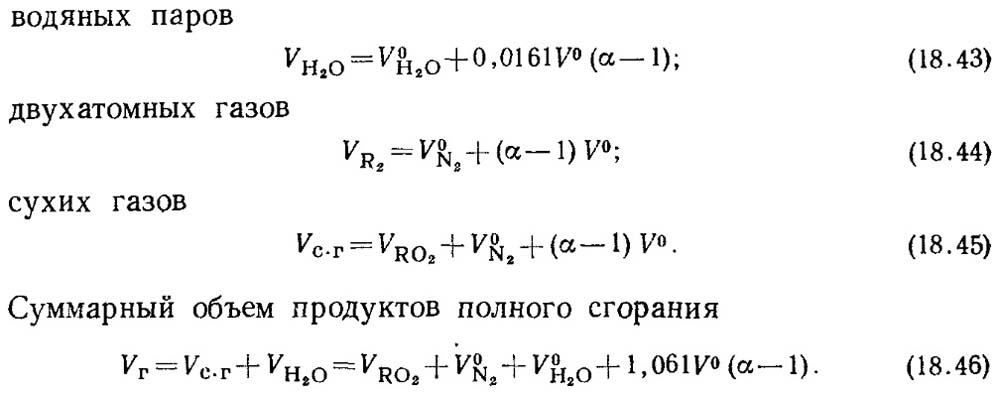
Величина VRO2 не зависит от значения коэффициента избытка воздуха.
Теоретические объемы продуктов сгорания 1 м3 газообразного топлива рассчитывают на основании стехиометрических реакций (18.28). При полном горении горючих составляющих газообразного топлива СО, Н2 и СmНn образуются двуокись углерода СO2 и водяные пары. При сгорании сероводорода H2S помимо водяных паров образуется сернистый газ SO2.
Объем трехатомных газов, м3/м3,
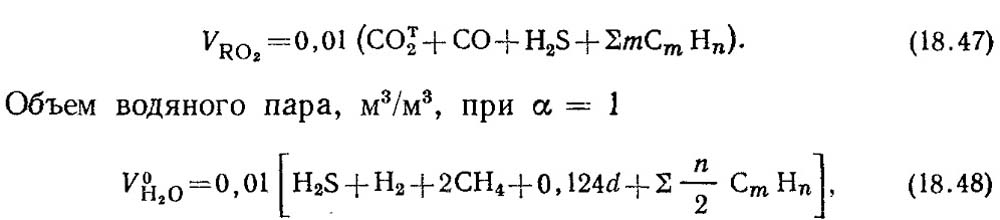
где а - влагосодержание газа, г/м3.
Объем азота, сухих газов и суммарный объем продуктов сгорания, так же как для жидкого и твердого топлив, определяют по формулам (18.42), (18.33) и (18.31).
При α > 1 действительный объем водяного пара, сухого газа и полный объем продуктов сгорания находят по формулам (18.43), (18.45) и (18.46). Если состав непредельных углеводородов СnН2n, входящих в газ, неизвестен, а общее их содержание не превышает 3 %, то в расчете они учитываются как С2Н4.
Расчеты горения по результатам анализа газов. Газовый анализ продуктов горения предназначен для контроля качества (полноты) сжигания топлива. Для этой цели используют химические газоанализаторы типа ВТИ и ГПХ - 3. Принцип их действия основан на избирательном поглощении компонентов, входящих в продукты сгорания, химическими реагентами, которыми заполнены поглотительные колонки газоанализатора. Например, для поглощения RO2 используют раствор КОН, а для поглощения О2 - щелочной раствор пирогаллола С6Н3(ОН)3.
В настоящее время широко применяют хроматографический газовый анализ, основанный на физических методах разделения газовых смесей на составляющие их компоненты. Принцип действия хроматографа базируется на различии адсорбционных свойств различных газов при их прохождении через слой сорбента (силикагеля).
Расчеты по результатам газового анализа производятся на объем сухих газов.
Определение окиси углерода при горении твердого и жидкого топлив. При неполном горении топлива в продуктах сгорания всегда содержится некоторое количество окиси углерода СО. Уравнение состава сухих продуктов сгорания имеет вид
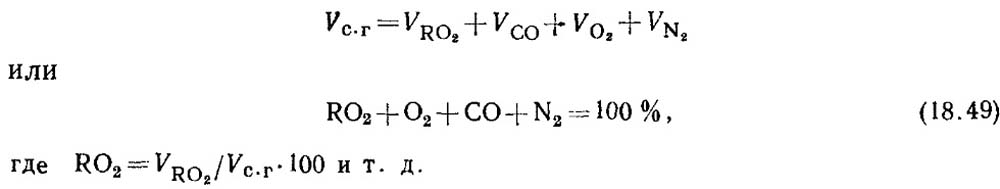
По результатам анализа газов определяют процентное содержание RO2 И O2 в продуктах сгорания.
Определение СО методом поглощения нежелательно из - за достаточно большой погрешности метода. Поэтому содержание СО в газах определяют расчетным путем.
При полном горении чистого углерода и α = 1 продукты сгорания содержат СO2 и N2, при этом СОмакс2 = ROмакс2 = 21 %. В горючей массе ископаемых топлив кроме углерода всегда содержится некоторое количество водорода. Поэтому концентрация ROмакс2 в сухих продуктах сгорания всегда меньше 21 %, т. е. с понижением содержания углерода и серы в топливе значение ROмакс2 также снижается. Существует некоторая безразмерная величина, с помощью которой можно установить соотношение между элементарным составом топлива и содержанием трех атомных газов в сухих продуктах сгорания. Эта величина называется топливной характеристикой, и обозначают ее буквой β.
Исходя из сказанного можно считать, что
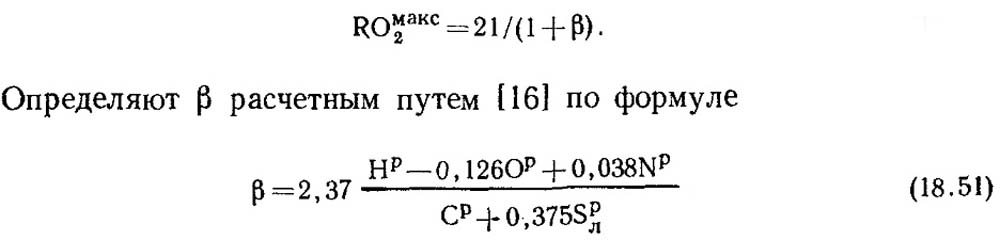
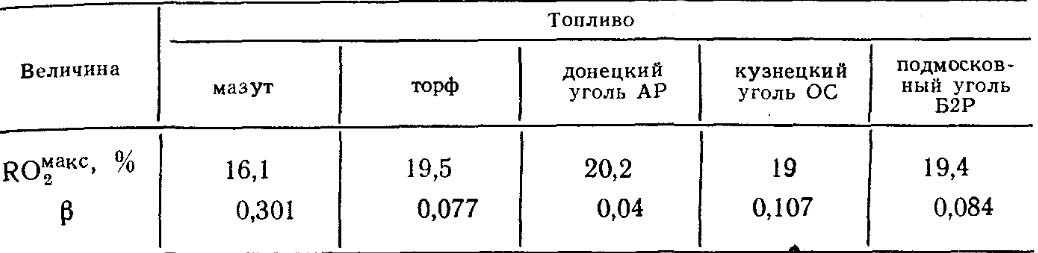
Значения ROмакс2 и β для каждого вида топлива определенного состава постоянны (табл. 18.4).
Таблица 18.4. значения ROмакс2 И β для некоторых видов топлива.
По мере увеличения коэффициента избытка воздуха β сверх единицы в сухих продуктах полного сгорания в результате избытка воздуха будет появляться свободный кислород и RО2 < ROмакс2. При известном значении α содержание RО2 можно приближенно определять по эмпирической формуле:
RО2 = ROмакс2/α(18.52)
В специальной литературе выводится так называемое уравнение полного горения топлива:
RО2 + О2 = 21 β RO2. (18.53)
Если правая и левая части уравнения (18.53) не равны между собой, то полного сгорания нет, и в этом случае разность (21 - βPRО2l) – ( RO2 + O2) = z называется характеристикой неполноты сгорания топлива.
Уравнение неполного горения топлива записывают в следующем виде:
21 - β RO2 = RO2 + O2 + (0,605 + β) СО.(18.53')
Зная содержание RО2 и O2 в дымовых газах и величину β, количество окиси углерода можно определить по следующей формуле, получаемой из равенства (18.53'):![]()
При использовании хроматографического метода газового анализа необходимость вычисления СО по формуле (18.54) отпадает, так как содержание окиси углерода можно определить непосредственно на хроматографе.
Расход воздуха на горение и количество продуктов сгорания топлива при неполном горении. Объем сухих продуктов сгорания определяют по результатам анализа газов в соответствии с уравнением (18.49) следующим образом. Процентное содержание RO2 в газах:
![]()
![]()
Содержание СО определяют по равенству (18.54). Окончательно получают
![]()
Определение горючих CO ставляющих СО, СН4 и Н2 при неполном горении газообразного топлива. Уравнение состава сухих продуктов сгорания можно записать в следующем виде: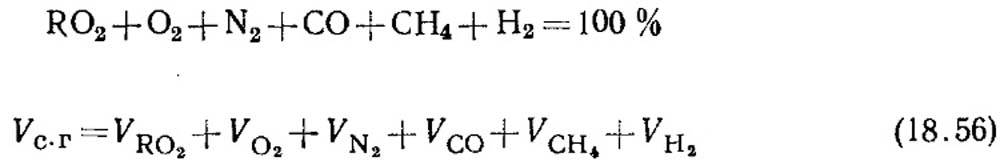
Содержание СН4 и Н2 в горючей части продуктов сгорания, как правило, бывает невелико. Основную часть составляет окись углерода. По результатам химического анализа газов определяют содержание RО2 и О2.
Хроматографическим методом газового анализа можно определять все составляющие горючей части продуктов сгорания СО, СН4 и Н2.
Если известны результаты анализа только по RО2 и О2, то для определения СО в газах значение топливной характеристики β принимают по справочным данным или при известном составе исходного горючего газа β определяют расчетным путем с обязательным учетом содержания СОт2 в газе:
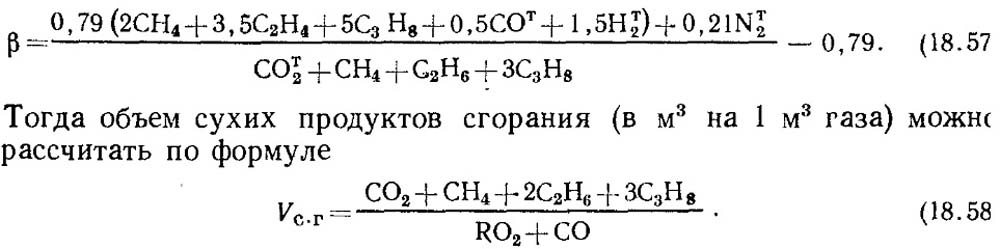
Следует отметить, что для искусственных газов, в которых содержится большое количество COт2, топливная характеристика β может оказаться отрицательной.
Определение коэффициента избытка воздуха. Коэффициент избытка воздуха определяется по данным газового анализа сухих продуктов сгорания. Для случая полного горения, когда в продуктах сгорания отсутствуют горючие составляющие СО, СН4, Н2
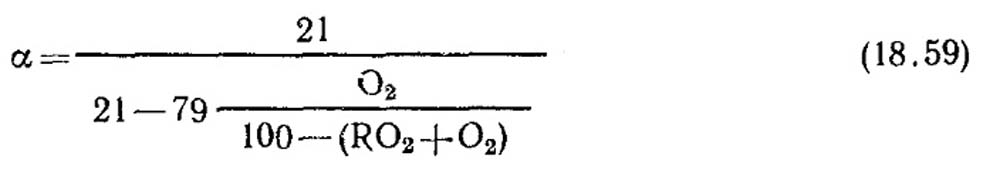
При неполном горении
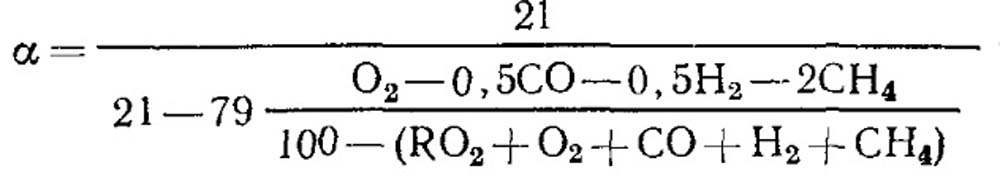
При полном сгорании топлива и известном значении ROмакс2 для определения можно воспользоваться формулой (18.52).
Пример. Определить низшую и высшую теплоту сгорания природного саратовского (елшанского) газа, имеющего следующий объемный состав, %: СН4 - 94, С2Н6 - 1,8, С3Н8 - 0,4, С4Н10 - 0,1, С5Н12 - 0,1,
СО2 - 0,1, N2 - 3,5.
Решение: 1. Низшая теплота сгорания, кДж/м3, составляет: метана СН4 - 35,8 × 103, этана С2Н4 - 64,6 ×103, пропана С3Н8 - 91,5 × 103, бутана С4Н10 - 119,0 ×103, пентана С5Н12 - 146,5 × 103.
По формуле (18.6) определяем
Qcn = (35,8×94 + 64,6×1,8 + 91,5×0,4+ 119×0,1 + 146,5×0,1) 103×0,01 = 35 300 кДж/м3.
Высшая теплота сгорания, кДж/м3, составляет: метана СН4 - 39,8 × 103, этана С2Н4 - 70 × 103, пропана С3Н8 - 99,5 ×103, бутана С4Н10 - 28,5 × 103, пентана С8Н12 - 157,5 ×103.
По формуле (18.17) находим
Qсв = (39,8 × 94 + 70 × 1,8 + 99,5 × 0,4 + 128,5 × 0,1 +157,5 × 0,01) 103 × 0,01 = 39 300 кДж/м3.